研究内容の概要
セントラルドグマは、DNAからmRNAが転写され、mRNAからタンパク質が翻訳されるという、分子生物学の基本概念です。一方で近年、ノンコーディングRNAというタンパク質を翻訳しないRNAが存在することが明らかになってきましたが、逆に私たちはノンコーディングRNAの少なくとも一部は翻訳されていることを発見しました。
この矛盾は、どのようなRNAが翻訳され、どのようなRNAが翻訳されないのかという、その基本原則すら不明であるために生じています。さらに近年、様々な技術の進歩により、これまで検出されなかった新しい種類のRNAやタンパク質が次々と発見されてきています。
私たちの研究室では、このような新しい種類のRNAやタンパク質を同定し、それらがどのようにして産生されるのかを理解し、さらにそれら新規分子の機能や生理的役割を明らかにしていきます。
私たちの主な研究内容
(1) 新しい種類のRNAやタンパク質を同定する。
(2) 新規RNAやタンパク質の発現制御機構を解明する。
(3) 新規分子の機能を解明し、遺伝子改変マウスなどを用いて生理的役割を明らかにする。
私たちの研究スタイル
私たちの研究室ではオミクス解析と遺伝子改変マウスの解析を主軸としています。
オミクス解析では、次世代シークエンサーを用いたTranscriptome解析(RNA-seq, m6A-seqなど)とTranslatome解析(Ribo-seq, TCP-seqなど)、さらに質量分析計を用いたProteome解析(DIAなど)を行っています。今後はさらにCryo-EM構造解析なども積極的に推進していきます。これら大規模データを解析するインフォマティクスにも力を入れています。私たちの研究室にはウェット専門やドライ専門、さらにウェットとドライの両方を行う人たちがいます。
遺伝子改変マウスを用いて、新規RNAやタンパク質の生命における役割の解明も進めています。私たちは特定の臓器や疾患に対象を絞っておらず、いつも新鮮な結果にワクワクしながら研究を進めています。私たちの研究成果が、将来的に疾患の原因の解明や治療に繋がることを期待しています。
Project紹介
ノンコーディングRNAから翻訳される新規タンパク質
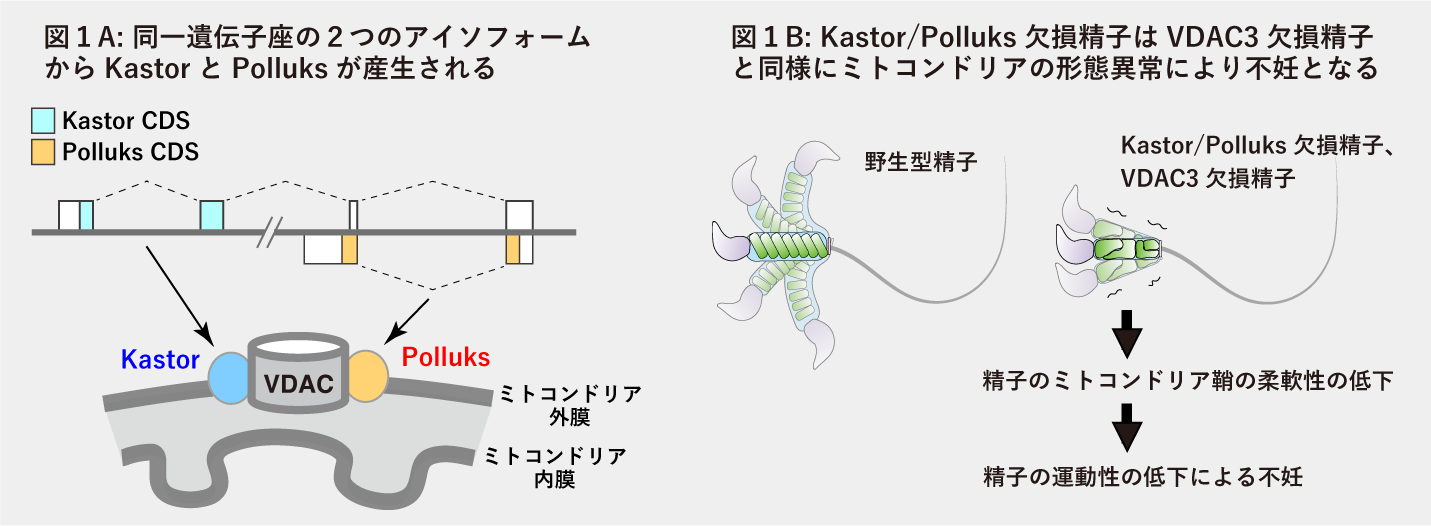
私たちは、これまでノンコーディングRNAとされていた遺伝子座から産生される、精子特異的に発現する2種類のタンパク質 (双子座の星から名前をとって、それぞれカストル Kastor、ポルックス Polluksと名付けました)を発見し、これらが精子の機能に重要であることを明らかにしました。
KastorとPolluksはアミノ酸配列が異なるタンパク質ですが、どちらもミトコンドリア外膜に局在し、電位依存性アニオンチャンネル(VDAC)と結合していました(図1A)。KastorとPolluksの両方を欠損する雄マウスでは精子のミトコンドリア鞘の形が異常になり不妊になりますが、これは以前に知られていたVDAC3欠損マウスと類似した異常でした。KastorとPolluksは協調的にVDAC3を制御して、精子におけるミトコンドリア鞘の形成と雄の生殖能力の獲得に必須であることがわかりました(図1B)。
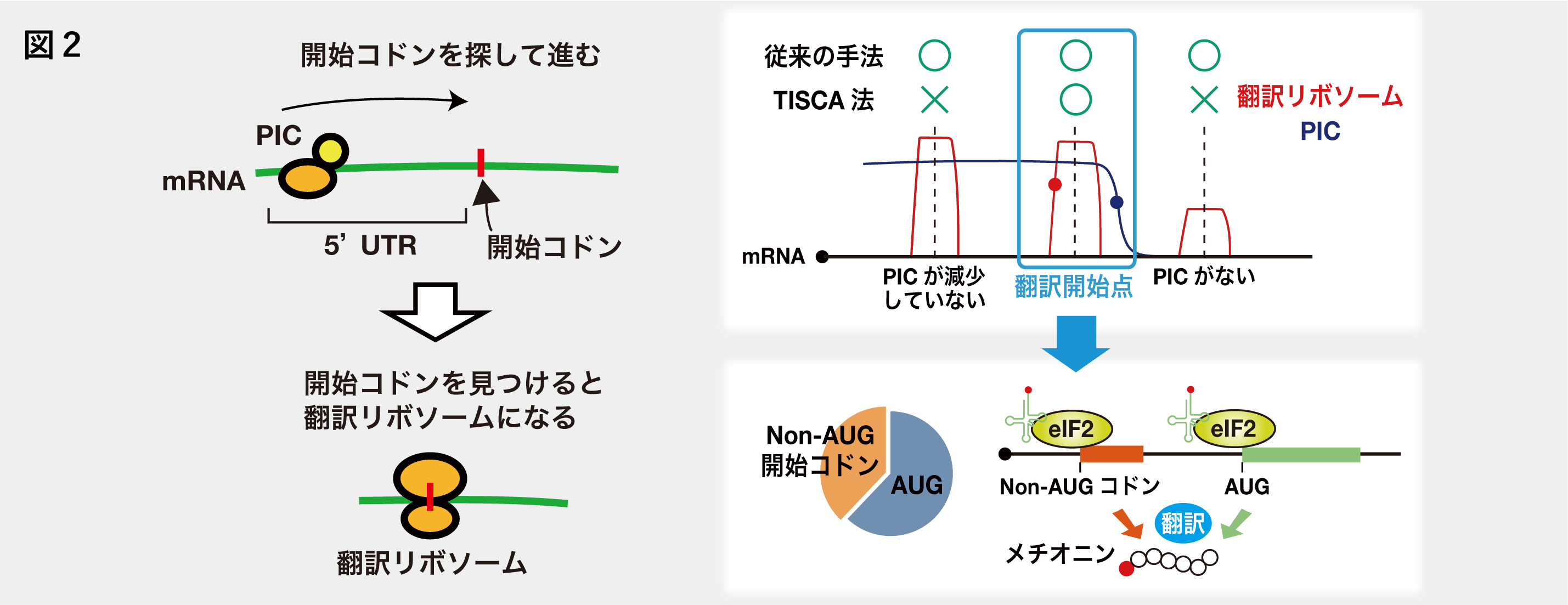
Non-AUG開始コドンから翻訳される新規タンパク質
真核生物では、タンパク質の翻訳はmRNAのAUG開始コドンから始まると考えられていますが、最近AUGとは異なるコドン(Non-AUG開始コドン)から翻訳が開始する非典型的翻訳が起こることが報告されてきています。私たちは、リボソームプロファイリング法を用いた翻訳開始点同定手法を改良したTISCA法を開発し、Non-AUG開始コドンを網羅的に同定しました。その結果、ヒト細胞の全ての翻訳のうち、4割程度はNon-AUG開始コドンから翻訳が起こると予測されました(図2)。またNon-AUG開始コドンから生じるタンパク質の最初のアミノ酸はAUG開始コドンと同様にメチオニンであること、Non-AUG開始コドンからの翻訳は主にeIF2に依存しているということが分かりました(図2)。さらに私たちは、Non-AUG開始コドンから翻訳される新規タンパク質の解析も進めています。
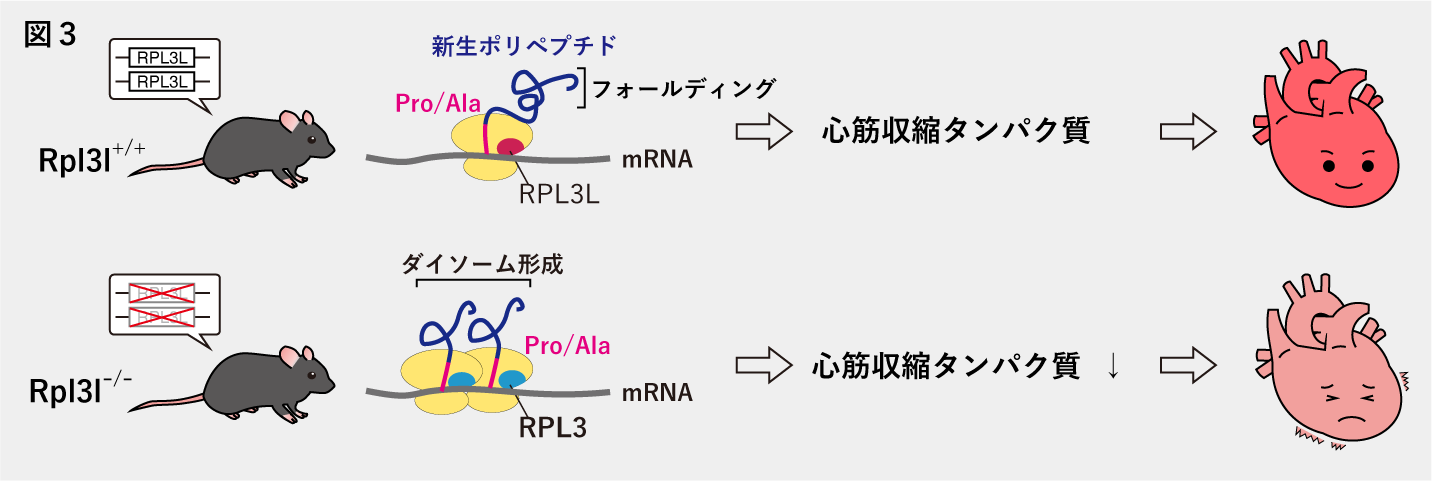
組織(横紋筋)特異的に存在するMyo-ribosomeの同定
リボソームは約80種類のリボソームタンパク質と4種類のリボソームRNAから構成されます。リボソームの構成はどの細胞や組織においても同じであるとこれまで考えられていましたが、近年の研究により、異なる構成を持つリボソームが存在することが明らかになってきていました。
RPL3のパラログであるRPL3Lが心筋と骨格筋(横紋筋)に特異的に発現しており、RPL3の代わりにRPL3Lを含むリボソームを、私たちはMyo-ribosomeと名付けました。Myo-ribosomeを欠損すると(RPL3L欠損)心臓の収縮力が低下することがわかりました。Myo-ribosomeを欠損した心臓ではリボソームの異常な衝突が増加しており、これにより心筋収縮に関与するタンパク質の発現量が減少し、心臓の収縮力の低下が生じたと考えられます(図3)。さらに、ヒトの心房細動や小児期の拡張型心筋症患者などでRPL3Lの遺伝子変異が報告されたことから、この組織特異的な翻訳制御機構の理解はこれら疾患の治療に繋がることが期待されます。